怕打針?浙大團(tuán)隊(duì)實(shí)現(xiàn)無創(chuàng)透皮給藥




減輕患者疾病治療期間的病痛,是醫(yī)療科研工作者不懈探索的重要課題。對于全球超5億的糖尿病患者而言,皮下注射胰島素目前是1型糖尿病與晚期2型糖尿病的標(biāo)準(zhǔn)治療手段。這類患者終身或長期依賴胰島素,需承受每天1-4次的注射疼痛,還可能面臨低血糖等不良反應(yīng),這些問題長期困擾著糖尿病臨床治療與患者生活質(zhì)量。
針對這一領(lǐng)域痛點(diǎn),北京時間11月20日,浙江大學(xué)牽頭在《自然》發(fā)表了題為《A skin-permeable polymer for non-invasive transdermal insulin delivery》的研究,提出了顛覆性的解決方案。該研究首次報道了一種皮膚滲透性高分子——聚[2-(N-氧化物-N,N-二甲基氨基)乙基甲基丙烯酸酯](OP),成功實(shí)現(xiàn)了胰島素?zé)o創(chuàng)透皮給藥,其胰島素鍵合物(OP-I)在糖尿病動物模型中,表現(xiàn)出與皮下注射胰島素相當(dāng)?shù)慕堤钳熜А?span style="display:none">jtb知多少教育網(wǎng)-記錄每日最新科研教育資訊

浙江大學(xué)化學(xué)工程與生物工程學(xué)院博士后韋秋雨、生命科學(xué)學(xué)院博士后何至、化工學(xué)院博士生李梓凡、教授周珠賢為共同第一作者,浙大化工學(xué)院教授申有青、生命科學(xué)學(xué)院教授周如鴻,英國帝國理工學(xué)院教授陳榮軍及浙大化工學(xué)院研究員相佳佳為共同通訊作者。
一個打破常規(guī)的現(xiàn)象
皮膚角質(zhì)層是人體隔絕外界物質(zhì)的第一道保護(hù)屏障,盡管其厚度只有10微米左右,但其中角質(zhì)細(xì)胞與脂質(zhì)的有序排列形成致密結(jié)構(gòu);緊鄰其下的活性表皮層中細(xì)胞間緊密連接。二者協(xié)同防御,構(gòu)成了一道堅(jiān)固的皮膚“城墻”。
透皮給藥擁有悠久的歷史,早在古代,人們就通過膏藥外敷的形式來治療疾病。目前部分麻藥、心血管疾病的等小分子藥物也實(shí)現(xiàn)了無創(chuàng)透皮給藥。但皮膚“城墻”屏障僅允許少數(shù)特定結(jié)構(gòu)的小分子穿透。胰島素等生物大分子,因分子量大、結(jié)構(gòu)復(fù)雜,難以突破皮膚這層壁壘,成為透皮遞藥研究的核心難點(diǎn)。
在前期的相關(guān)研究中,申有青團(tuán)隊(duì)發(fā)現(xiàn)了一種兩性離子聚合物OP,它在腫瘤組織中具有出眾的滲透性,能夠高效遞送抗腫瘤藥物。

“由此,我們猜測,OP是否也能高效地滲透皮膚組織呢?”這個靈光一現(xiàn)的想法,讓長期專注高分子藥物遞送研究的申有青,敏銳地捕捉到了潛在的研究方向。
隨后的實(shí)驗(yàn)中,OP在皮膚上也表現(xiàn)出的高滲透性,讓團(tuán)隊(duì)成員倍感驚喜。“這打破了我們對‘大分子無法透過皮膚屏障’的常規(guī)認(rèn)知。”申有青表示,團(tuán)隊(duì)隨即聯(lián)合起周如鴻、陳榮軍團(tuán)隊(duì),展開系統(tǒng)研究,深入分析OP透過皮膚的具體路徑和機(jī)制,進(jìn)一步探索它在透皮給藥領(lǐng)域的應(yīng)用可能。
胰島素“快遞員”——OP
在自然進(jìn)化過程中,皮膚形成了從表面的酸性微環(huán)境到內(nèi)部中性環(huán)境的天然pH梯度,OP正是利用了皮膚的這一特性,通過動態(tài)調(diào)整自身帶電形態(tài),沿著皮膚結(jié)構(gòu)巧妙滲透。
首先,OP含有的三級胺氧化物基團(tuán),在皮膚表面(皮脂膜及角質(zhì)層表層)pH≈5的弱酸性條件下,發(fā)生質(zhì)子化,帶上正電。通過靜電相互作用,OP與角質(zhì)層細(xì)胞間隙帶負(fù)電的脂肪酸緊密結(jié)合,形成局部高濃度藥物儲庫,為后續(xù)滲透提供濃度梯度。

OP-I在皮膚角質(zhì)層擴(kuò)散的分子動力學(xué)模擬
隨著滲透深度增加,角質(zhì)層內(nèi)側(cè)至活性表皮層的pH升至中性,OP發(fā)生去質(zhì)子化轉(zhuǎn)變?yōu)殡娭行郧曳浅SH水的聚兩性離子,此時它失去與角質(zhì)層脂質(zhì)的靜電相互作用,得以快速擴(kuò)散通過角質(zhì)細(xì)胞間隙,實(shí)現(xiàn)高效滲透。
“我們通過分子動力學(xué)模擬與結(jié)合自由能計(jì)算,從原子層面闡明了這一‘適配皮膚生理pH梯度的智能遞藥機(jī)制’。”周如鴻介紹。
團(tuán)隊(duì)將OP與胰島素化學(xué)偶聯(lián),構(gòu)建出鍵合物OP-I。進(jìn)入活性表皮層及真皮層后,OP-I沿細(xì)胞膜表面發(fā)生“跳躍式移動(hopping)”,有效避開了細(xì)胞內(nèi)酶的降解。這種“跳躍遞送”透過深層皮膚后,最終經(jīng)真皮層淋巴管進(jìn)入體循環(huán),實(shí)現(xiàn)了胰島素的全身遞送。這就像是讓OP這個可以靈活變形的“快遞員”,帶著胰島素“包裹”鉆過皮膚“城墻”遞送至血液中。

不局限于糖尿病,大分子透皮新未來
為系統(tǒng)驗(yàn)證該透皮給藥技術(shù)的有效性與安全性,研究團(tuán)隊(duì)在兩種糖尿病模型動物中開展評估。結(jié)果表明,OP-I能高效靶向肝臟、脂肪、肌肉等血糖調(diào)控關(guān)鍵組織,為其強(qiáng)效降糖效應(yīng)提供了明確機(jī)制支撐。
具體而言,對STZ誘導(dǎo)的糖尿病小鼠經(jīng)皮給予116 U/kg OP-I,血糖在1 h內(nèi)即可快速降至正常范圍,降糖效果與皮下注射胰島素相當(dāng),藥效持續(xù)時間延長至12 h以上且無低血糖風(fēng)險,SPR實(shí)驗(yàn)進(jìn)一步表明,OP-I與胰島素受體的結(jié)合能力與天然胰島素相當(dāng);對于皮膚結(jié)構(gòu)更接近人類的糖尿病迷你豬,僅需29 U/kg的經(jīng)皮給藥劑量,即可實(shí)現(xiàn)血糖正常化。
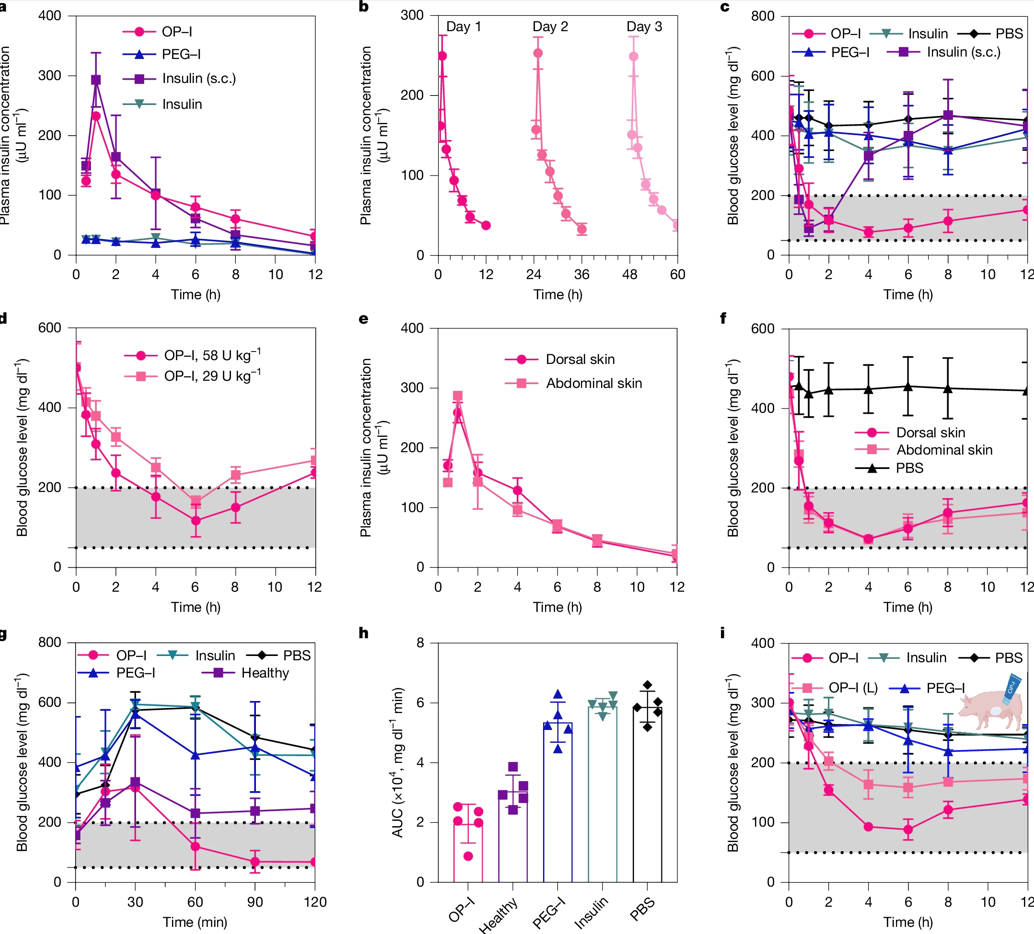
OP-I經(jīng)皮給藥后的降糖效果
不同于傳統(tǒng)化學(xué)促滲劑的屏障破壞,OP-I持續(xù)給藥后,動物皮膚角質(zhì)層結(jié)構(gòu)完整、細(xì)胞間隙無擴(kuò)張,也沒有出現(xiàn)炎癥等副作用。毒性試驗(yàn)表明,OP同樣具備極高的體內(nèi)安全性。隨著臨床研究的持續(xù)推進(jìn),未來可能只需通過皮膚涂藥便可實(shí)現(xiàn)血糖平穩(wěn)控制,顯著提升治療效率。對糖尿病患者而言,“告別針頭”將不再是奢望。
“更重要的是,我們這個技術(shù)平臺不僅適用于胰島素遞送,還能用于其他重要的生物大分子。”申有青介紹,目前,該體系已成功拓展至利拉魯肽、司美格魯肽、治療性蛋白、單克隆抗體及siRNA等多類物質(zhì)的遞送。
“該體系的普適性,為生物大分子無損透皮給藥開辟了全新研究方向。”申有青補(bǔ)充道。目前,相關(guān)技術(shù)已轉(zhuǎn)讓企業(yè)并推進(jìn)臨床轉(zhuǎn)化,不僅有望重構(gòu)生物大分子給藥體系,更能為糖尿病、類風(fēng)濕關(guān)節(jié)炎等需長期注射的慢性疾病提供創(chuàng)新治療方案。
(文 查蒙 圖 哲映 部分源于課題組)
本文鏈接:http://knowith.com/news-3-4464.html怕打針?浙大團(tuán)隊(duì)實(shí)現(xiàn)無創(chuàng)透皮給藥
聲明:本網(wǎng)頁內(nèi)容由互聯(lián)網(wǎng)博主自發(fā)貢獻(xiàn),不代表本站觀點(diǎn),本站不承擔(dān)任何法律責(zé)任。天上不會到餡餅,請大家謹(jǐn)防詐騙!若有侵權(quán)等問題請及時與本網(wǎng)聯(lián)系,我們將在第一時間刪除處理。